L’équipe de l’unité fonctionnelle dysfonctionnements immunitaires dirigée par le Pr Renato Monteiro au sein de l’hôpital Bichat–Claude-Bernard AP-HP, d’Université Paris Cité, de l’Inserm et du CNRS, et l’équipe immunologie du diabète dirigée par Dr Agnès Lehuen, au sein de l’Institut Cochin (Inserm/CNRS/Université Paris Cité), ont mené des travaux en collaboration avec des cliniciens et virologues des hôpitaux de l’AP-HP Bichat-Claude-Bernard, Cochin et Lariboisière, du CHU et de l’Inserm U1100 de Tours. Ces recherches ont permis de démontrer le rôle des cellules immunitaires MAIT (Mucosal Associated Invariant T cells) dans l’infection par le virus SARS-CoV-2. Cette étude met en lumière de nouveaux mécanismes pathogènes liant les fonctions inflammatoires et tueuses des cellules MAIT avec la sévérité et la mortalité de la maladie.
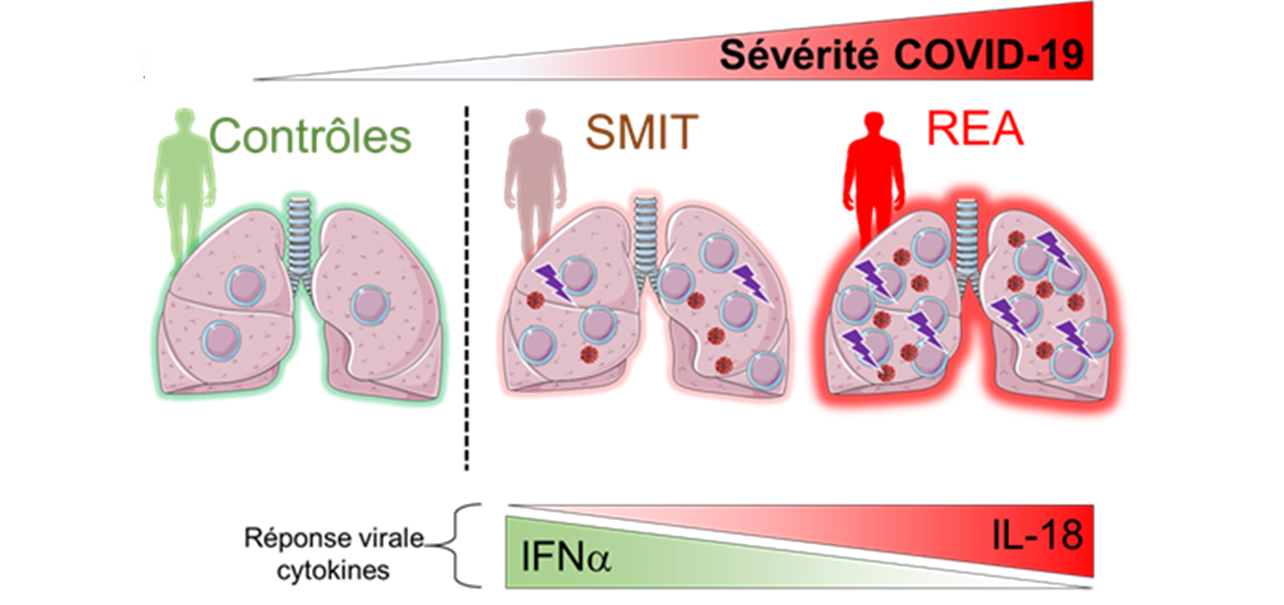
Chez les patients COVID-19, plus la pathologie est sévère, plus les cellules MAIT sont recrutées dans les poumons, elles produisent des cytokines pro-inflammatoires et deviennent des cellules tueuses pouvant endommager les tissus pulmonaires. Ces modifications pathologiques des cellules MAIT sont associées à la présence accrue de monocytes/macrophages qui produisent plus d’IL-18 pro-inflammatoire et moins d’IFNα antiviral.
© Tous droits réservés
Le SARS-CoV-2 est responsable de la pandémie COVID-19 qui a débuté en décembre 2019. L’infection par ce virus peut induire dans certains cas un syndrome de détresse respiratoire aiguë dû à une réponse inflammatoire incontrôlée. Les cellules MAIT, présentes dans les poumons, jouent un rôle important dans la détection et la lutte contre les infections bactériennes et virales. Afin de déterminer le phénotype des cellules MAIT dans la COVID-19, l’étude a été menée sur plus de 150 patients hospitalisés ou personnes non-infectées.
Que font les cellules immunitaires MAIT alors que le corps lutte contre le SARS-CoV-2 ? Leur fréquence diminue drastiquement dans le sang des patients atteints de COVID-19 alors qu’elle augmente dans le poumon. Chez ces patients, les cellules MAIT sont très activées, et produisent de grandes quantités de cytokines pro-inflammatoires ainsi que des facteurs capables de tuer des cellules cibles. Plus les « patients COVID-19 » sont dans un état grave, plus ces altérations des cellules MAIT sont importantes. Déterminer l’étendue du dysfonctionnement des cellules MAIT sanguines permet de prédire la survie des patients.
Les auteurs de cette publication ont montré que dans le sang des « patients COVID-19 », plus la maladie est sévère, plus il y a de monocytes inflammatoires. Les monocytes des patients hospitalisés en maladies infectieuses produisent plus d’IFNα, une cytokine réduisant la charge virale, alors que ceux des patients en réanimation produisent plus d’IL-15 et d’IL-18, des cytokines qui favorisent la réaction inflammatoire incontrôlée et l’activation des cellules MAIT.
Par des expériences de cultures de cellules immunitaires, les scientifiques ont démontré que l’infection par le SARS-CoV-2 de macrophages, les principales cellules immunitaires du poumon, induit l’activation et les fonctions tueuses des cellules MAIT, qui peuvent ainsi éliminer ces cellules infectées mais également induire des lésions tissulaires.
L’ensemble de cette étude a mis en évidence un rôle délétère des cellules MAIT dans les cas graves de COVID-19. Ces résultats permettent ainsi d’utiliser ces cellules comme marqueurs de sévérité de l’infection et de pronostic précoce pour les patients hospitalisés atteints de cette maladie. Bloquer l’action tueuse de ces cellules pourrait représenter une nouvelle approche thérapeutique.
Référence : Outcome of SARS-CoV-2 infection is linked to MAIT cell activation and cytotoxicity : Héloïse Flament1,2•, Matthieu Rouland3,•, Lucie Beaudoin3,•, Amine Toubal3, •, Léo Bertrand3, Ϯ, Samuel Lebourgeois4,Ϯ, Camille Rousseau3, Pauline Soulard3, Zouriatou Gouda3, Lucie Cagninacci3, Antoine C. Monteiro4, Margarita Hurtado-Nedelec1,2, Sandrine Luce3, Karine Bailly3, Muriel Andrieu3, Benjamin Saintpierre3, Franck Letourneur3, Youenn Jouan5,6, Mustapha Si-Tahar5, Thomas Baranek5, Christophe Paget5, Christian Boitard3,7, Anaïs Vallet-Pichard3,8, Jean-François Gautier9, Nadine Ajzenberg10, Benjamin Terrier11, Frédéric Pène3,12, Jade Ghosn13, Xavier Lescure13, Yazdan Yazdanpanah13, Benoit Visseaux4, Diane Descamps4, Jean-François Timsit14, Renato C. Monteiro1,2, Agnès Lehuen3 (•,Ϯ co-auteurs). Nature immunology.
À lire aussi

La semaine du cerveau 2026 à l’Université Paris Cité

Prix Jeunes Talents France L’Oréal-UNESCO Pour les Femmes et la Science : Appel à candidatures 2026
La Fondation L'Oréal, en partenariat avec la Commission nationale française pour l'UNESCO et l'Académie des sciences, déclare officiellement ouvert l'appel à candidatures de l'édition 2026 du Prix Jeunes Talents France L'Oréal-UNESCO Pour les Femmes et la Science :...

Suivi des maladies chroniques : un patient sur deux serait ouvert à la téléconsultation
L’étude REACTIVE, coordonnée par la Dre Tiphaine Lenfant et le Pr Viet-Thi Tran et menée par des équipes de médecine interne de l’hôpital européen Georges-Pompidou AP-HP, du centre d’épidémiologie clinique de l’hôpital Hôtel-Dieu AP-HP, de l’Université Paris Cité, de...

Le Collège de l’Académie nationale de médecine : une première promotion marquée par l’engagement de l’Université Paris Cité
Créé en décembre 2024, le Collège de l’Académie nationale de médecine se veut être un lieu d’échanges entre les académiciens et des jeunes médecins, chirurgiens, biologistes, scientifiques, pharmaciens, vétérinaires. Il réunit ainsi 38 jeunes scientifiques, dont 15...
